

ビウレット法の原理とタンパク質定量
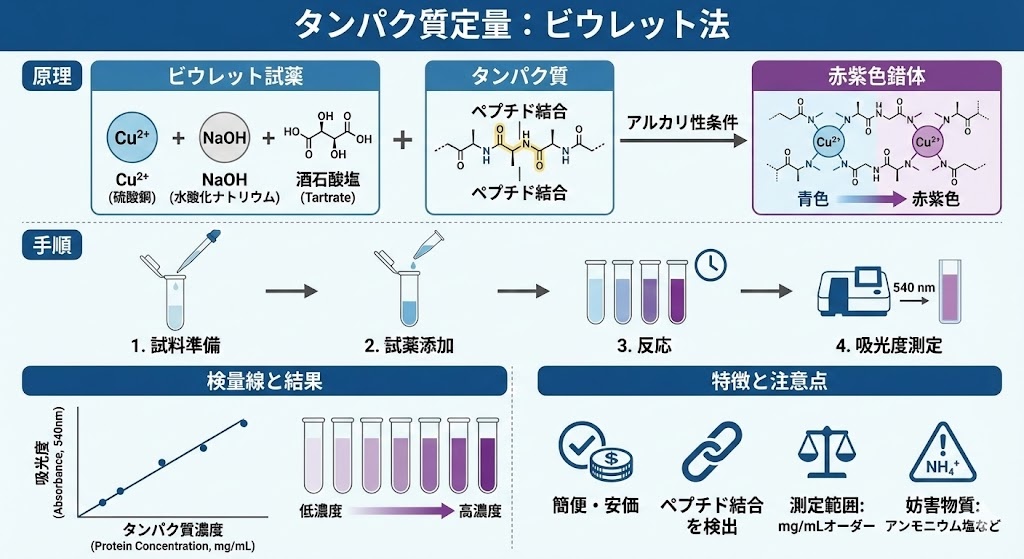
ビウレット法は、タンパク質やポリペプチドを検出・定量するための最も古典的な比色定量法の一つです。この方法は、ペプチド結合と銅イオン(Cu2+)の反応を利用したもので、1833年にドイツで初めて発見され、その後1857年にポーランドの生理学者G.ピオトロウスキーによって再発見されました。
この方法の名前の由来は、有機化合物「ビウレット(NH2-CO-NH-CO-NH2)」が銅イオンと反応して特徴的な呈色を示すことから来ています。しかし、実際の反応ではビウレットそのものは生成しません。あくまでも反応の類似性からこの名前が付けられています。
タンパク質濃度測定において、ビウレット法は他の方法と比較して操作が簡便であり、タンパク質の種類による発色の強さの差が小さいという特徴があります。これは、タンパク質の単位質量あたりのペプチド結合数が、タンパク質の種類が異なっていてもほぼ一定であるためです。
ビウレット法の化学反応メカニズム
ビウレット法の反応メカニズムは、アミノ酸が3つ以上連結したトリペプチド以上のペプチドやタンパク質が、アルカリ性条件下で銅イオン(Cu2+)と反応することに基づいています。この反応の詳細なプロセスは以下のとおりです:
- まず、アルカリ性環境(通常はNaOH水溶液を使用)でタンパク質溶液を処理します。
- 次に、硫酸銅(CuSO4)水溶液を添加します。
- タンパク質のペプチド結合中の窒素原子が銅イオン(Cu2+)に配位結合します。
- この配位結合により、Cu2+からCu+への還元が起こります。
- 結果として、赤紫色から青紫色の複合体が形成されます。
この呈色反応は540 nm付近の波長で最大吸収を示し、この吸光度を測定することでタンパク質濃度を定量できます。一つの銅イオン(Cu2+)分子は、4〜6個のペプチド結合と複合体を形成します。
重要なのは、この反応がトリペプチド以上のペプチドでのみ起こり、単一のアミノ酸や2つのアミノ酸からなるジペプチドでは起こらないという点です。これは、反応に必要な特定の立体配置が、少なくとも3つのアミノ酸が連結した構造でのみ形成されるためです。
ビウレット法のプロトコールと実験手順
ビウレット法を用いたタンパク質定量の実験手順は比較的シンプルで、以下のステップで行います:
【ビウレット試薬の調製法】
これらを混合し、最終的に純水で2Lにメスアップします。調製した試薬は室温で数ヶ月保存可能です。
【実験手順】
- タンパク質溶液サンプル(100μL)にビウレット試薬を1mL加え、ボルテックスで攪拌します。
- 室温で20〜30分以上静置します。
- 分光光度計を用いて540nmの吸光度を測定します。
- 標準タンパク質(通常はBSA:ウシ血清アルブミン)の希釈系列で作成した検量線をもとに、サンプルのタンパク質濃度を算出します。
この方法は特別な装置を必要とせず、一般的な実験室で容易に実施できるため、基礎研究から臨床検査まで幅広く利用されています。ただし、測定範囲が5〜160mg/mLと比較的高濃度域に限られるため、低濃度のサンプルには適していません。
ビウレット法の長所と短所の詳細分析
ビウレット法には、他のタンパク質定量法と比較していくつかの特徴的な長所と短所があります。実験計画時にはこれらを考慮して最適な方法を選択することが重要です。
【長所】
- タンパク質組成の違いによる影響を受けにくい:ペプチド結合を検出するため、アミノ酸組成に関わらず安定した結果が得られます。
- 操作が簡便:複雑な前処理や特殊な装置を必要としないため、短時間で結果が得られます。
- 界面活性剤や脂質の影響を受けにくい:サンプル中に界面活性剤や脂質が含まれていても測定への影響が少ないです。
- コスト効率が良い:試薬が比較的安価で、特殊な機器を必要としないため、経済的です。
- 再現性が高い:適切に実施すれば、実験間のばらつきが少なく信頼性の高い結果が得られます。
【短所】
- 測定感度が低い:定量範囲は5〜160mg/mLと比較的高濃度域に限られ、微量タンパク質の検出には適していません。
- 特定の物質による干渉:高濃度のトリス緩衝液、アミノ酸、スクロース、アンモニウムイオンなどが発色反応に影響を与えることがあります。
- 廃液処理の問題:銅などの重金属を含む廃液が発生するため、適切な処理が必要です。
- 反応時間が比較的長い:呈色反応の安定化に20〜30分程度の時間を要します。
- 特定のタンパク質では反応が不安定:一部のタンパク質では正確な定量が難しい場合があります。
これらの特性を理解した上で、実験の目的や条件に応じて適切な定量法を選択することが重要です。例えば、高感度が必要な場合はBCA法やBradford法などの改良法を検討するとよいでしょう。
ビウレット法と派生した改良法の比較
ビウレット法は古典的なタンパク質定量法ですが、その原理をベースに感度や特異性を向上させた様々な改良法が開発されています。それぞれの特徴を比較してみましょう。
【ビウレット法】
- 測定範囲:5〜160mg/mL
- 原理:ペプチド結合と銅イオンの反応
- 特徴:操作が簡便、タンパク質の種類による差が小さい
- 主な用途:血清や尿中の総タンパク質定量
【ローリー法(Lowry法)】
- 測定範囲:0.01〜1.0mg/mL
- 原理:ビウレット反応とフェノール試薬(Folin-Ciocalteu試薬)による発色
- 特徴:ビウレット法より約100倍感度が高い
- 短所:界面活性剤や還元剤の影響を受けやすい
【BCA法】
- 測定範囲:0.02〜2.0mg/mL
- 原理:ビウレット反応で生じたCu+とビシンコニン酸(BCA)の反応
- 特徴:ローリー法より操作が簡便で、界面活性剤の影響を受けにくい
- 短所:還元物質の影響を受けやすい
- 測定範囲:0.001〜1.4mg/mL
- 原理:クマシーブリリアントブルーG-250の色素結合
- 特徴:高感度、迅速(2分以内で発色)
- 短所:タンパク質の種類による差が大きい
【WST法】
- 測定範囲:0.5〜50μg/mL
- 原理:テトラゾリウム塩の還元による発色
- 特徴:超高感度、操作が簡便
- 短所:還元物質の影響を大きく受ける
これらの方法は、それぞれ特有の長所と短所があります。例えば、低濃度サンプルの測定にはBradford法やWST法が適していますが、タンパク質の種類による差が大きいという欠点があります。一方、ビウレット法はタンパク質の種類による差が小さいものの、感度が低いという特徴があります。
実験の目的や条件に応じて最適な方法を選択することが重要です。例えば、粗抽出液の総タンパク質量を測定する場合はビウレット法やBCA法が、精製タンパク質の微量定量にはBradford法やWST法が適しているでしょう。
ビウレット法の実験トラブルシューティング
ビウレット法を用いたタンパク質定量実験では、様々な要因によって測定誤差や問題が生じることがあります。ここでは、よくある問題とその解決策について解説します。
【問題1:発色が弱い、または不安定】
- 原因:試薬の劣化、反応時間不足、温度条件の不適切さ
- 解決策:
- 新しい試薬を調製する
- 反応時間を30分以上確保する
- 反応温度を一定(20〜25℃)に保つ
- サンプルと試薬の混合比を確認する
- 新しい試薬を調製する
【問題2:バックグラウンドが高い】
- 原因:キュベットの汚れ、試薬の混濁、サンプル中の不純物
- 解決策:
- キュベットを十分に洗浄する
- 試薬をろ過して混濁物を除去する
- サンプルを遠心分離して不溶物を除去する
- 適切なブランクを用いて補正する
- キュベットを十分に洗浄する
【問題3:検量線の直線性が悪い】
- 原因:標準タンパク質の調製ミス、濃度範囲の不適切さ
- 解決策:
- 標準タンパク質の濃度を正確に調製し直す
- 測定範囲内(5〜160mg/mL)に収まるよう希釈する
- 複数回測定して平均値を用いる
- 検量線の濃度ポイントを増やす
- 標準タンパク質の濃度を正確に調製し直す
【問題4:再現性が低い】
- 原因:ピペッティングエラー、反応条件のばらつき
- 解決策:
- キャリブレーション済みのピペットを使用する
- 同一条件で実験を行う(時間、温度など)
- サンプルを十分に混合する
- 三重測定など複数回の測定を行う
- キャリブレーション済みのピペットを使用する
【問題5:特定の試料で異常値】
- 原因:試料中の干渉物質(トリス、アミノ酸、還元剤など)
- 解決策:
- 干渉物質を透析や限外ろ過で除去する
- 試料の前処理方法を変更する
- 他の定量法(BCA法やBradford法など)を併用して確認する
- 標準添加法で干渉の程度を評価する
- 干渉物質を透析や限外ろ過で除去する
これらのトラブルシューティング対策を知っておくことで、より信頼性の高い実験結果を得ることができます。特に初めてビウレット法を実施する場合は、既知濃度のタンパク質溶液を用いて予備実験を行い、測定系の妥当性を確認しましょう。
また、実験ノートに詳細な条件を記録しておくことで、問題が発生した際の原因特定が容易になります。定期的な機器のメンテナンスや試薬の品質チェックも、安定した結果を得るために重要です。
