

ローリー法のメリットとタンパク質定量
タンパク質の定量分析は生化学研究や品質管理において非常に重要なプロセスです。様々な定量法の中でも、ローリー法(Lowry Method)は長年にわたり広く使用されてきた手法の一つです。この方法は1951年にOliver H. Lowryらによって発表され、当時としては画期的な感度と精度を実現しました。実際、ローリー法を発表した論文は科学論文の中で最も引用数の多い論文の一つとなっています。
ローリー法はビウレット法を基盤として改良された方法であり、その原理を理解することで、この手法の持つ特徴やメリットをより深く把握することができます。
関連記事)ビウレット法の原理
ローリー法の原理とタンパク質濃度測定の仕組み
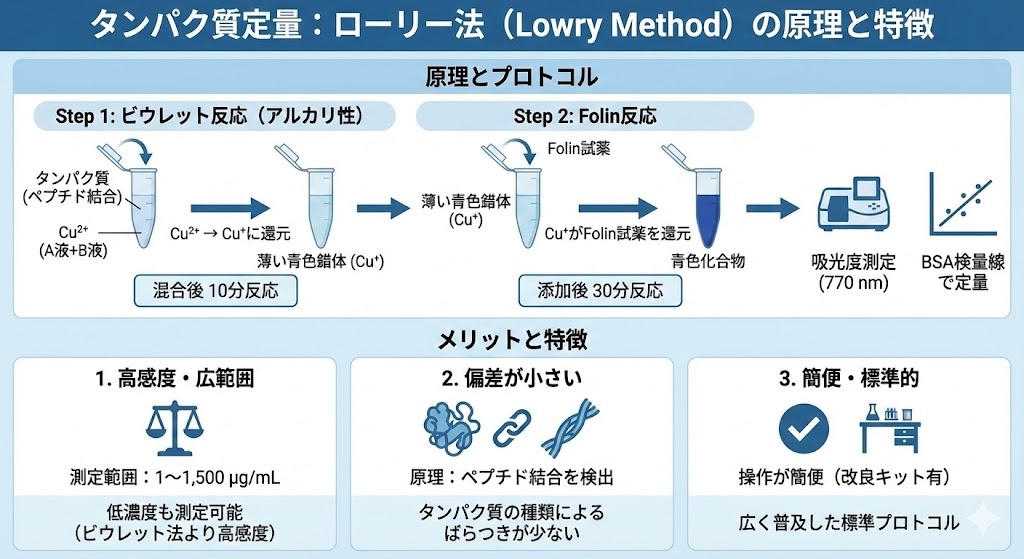
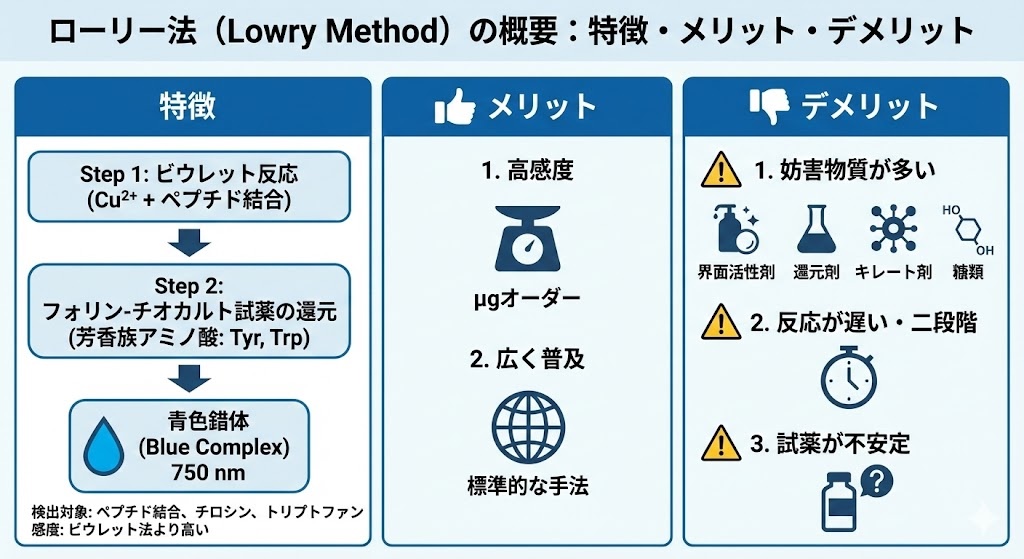
ローリー法は、タンパク質の定量分析において二段階の化学反応を利用しています。第一段階では、アルカリ性条件下でタンパク質中のペプチド結合と二価の銅イオン(Cu²⁺)が反応し、錯体を形成します。この反応によって、Cu²⁺がCu⁺に還元されます。これはビウレット反応と呼ばれ、この段階だけでも薄い青色の呈色が観察できます。
第二段階では、Folin-Ciocalteu試薬(リンモリブデン酸とリンタングステン酸の複合体)を添加します。この試薬は第一段階で生成したCu⁺によって還元され、650〜750 nm付近に吸収極大を持つ青色の化合物を形成します。この青色の濃さはタンパク質の濃度に比例するため、770 nmの吸光度を測定することで、サンプル中のタンパク質濃度を定量することができます。
具体的なプロトコルとしては、まずA液(Na₂CO₃とNaOH)とB液(Cu₂SO₄と酒石酸ナトリウムカリウム)を混合し、この混合液をサンプルに加えます。10分間の反応後、Folin試薬を添加し、さらに30分間反応させた後、吸光度を測定します。標準試料としてBSA(ウシ血清アルブミン)の希釈系列を用いて検量線を作成し、未知サンプルの濃度を算出します。
ローリー法のメリットと高感度測定の特徴
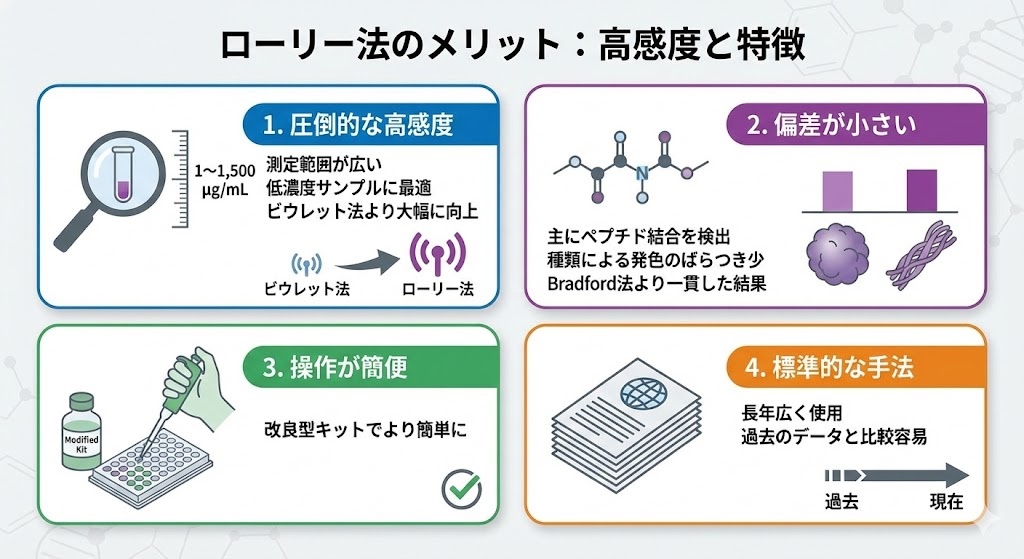
ローリー法の最大のメリットは、その高い感度にあります。測定範囲は1〜1,500 µg/mLと広く、特に低濃度のタンパク質サンプルの定量に適しています。これはビウレット法と比較して感度が大幅に向上しており、微量のタンパク質を扱う実験において非常に有用です。
また、ローリー法はタンパク質間の偏差が比較的小さいという特徴があります。これは、主にペプチド結合を検出する原理に基づいているため、タンパク質の種類による発色のばらつきが少ないことを意味します。Bradford法のように特定のアミノ酸残基に依存する方法と比較すると、より一貫した結果が得られやすいのです。
操作の簡便さもローリー法のメリットの一つです。特に改良型のModified Lowry Protein Assay Kitでは、不安定な試薬を安定な試薬に置き換えることで、より簡単に実験を行うことができるようになっています。
さらに、ローリー法は長年にわたって広く使用されてきた手法であるため、多くの研究室で標準的なプロトコルが確立されています。これにより、過去の研究結果との比較が容易になるという利点もあります。
ローリー法の短所と界面活性剤による影響
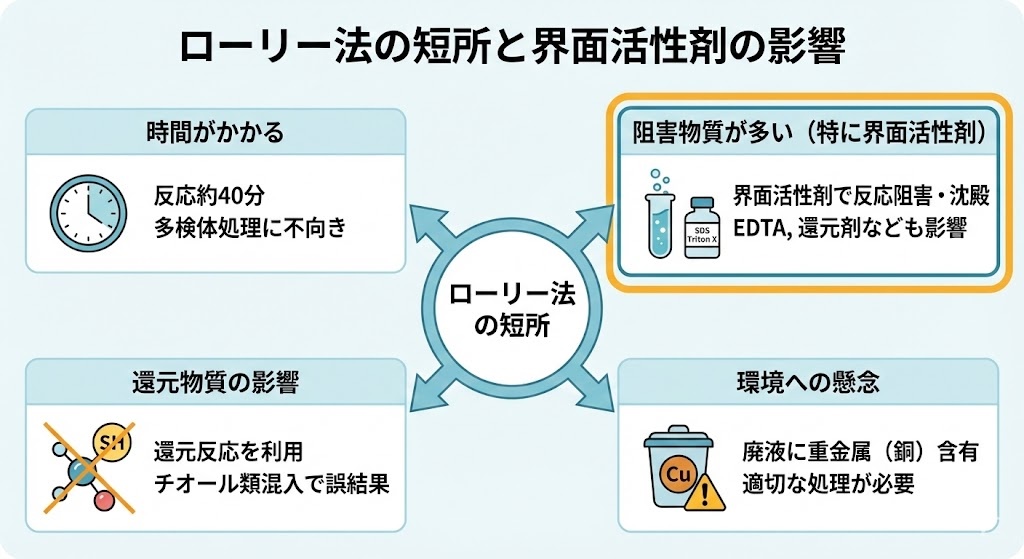
ローリー法にはいくつかの短所も存在します。まず、反応に時間がかかることが挙げられます。プロトコル全体で約40分を要するため、多数のサンプルを処理する場合には時間的な制約となることがあります。
また、ローリー法は様々な物質によって阻害されやすいという欠点があります。特に、界面活性剤(SDS、Triton Xなど)、キレート剤(EDTA)、還元剤(ジチオスレイトール、2-メルカプトエタノール)、グリセロール、トリシン、トリスバッファーなどが存在すると、反応が阻害されたり沈殿が生じたりすることがあります。これらの物質はタンパク質の抽出や精製過程でよく使用されるため、実験設計時には注意が必要です。
さらに、ローリー法は還元反応を利用しているため、サンプル中に還元物質が混入していると、誤った結果を示す可能性があります。チオール類やフェノール類などの還元物質は発色を妨害するため、これらを含むサンプルの分析には適していません。
また、廃液に重金属である銅が含まれるという環境面での懸念もあります。実験室では適切な廃液処理が求められます。
ローリー法とBCA法・Bradford法の比較分析
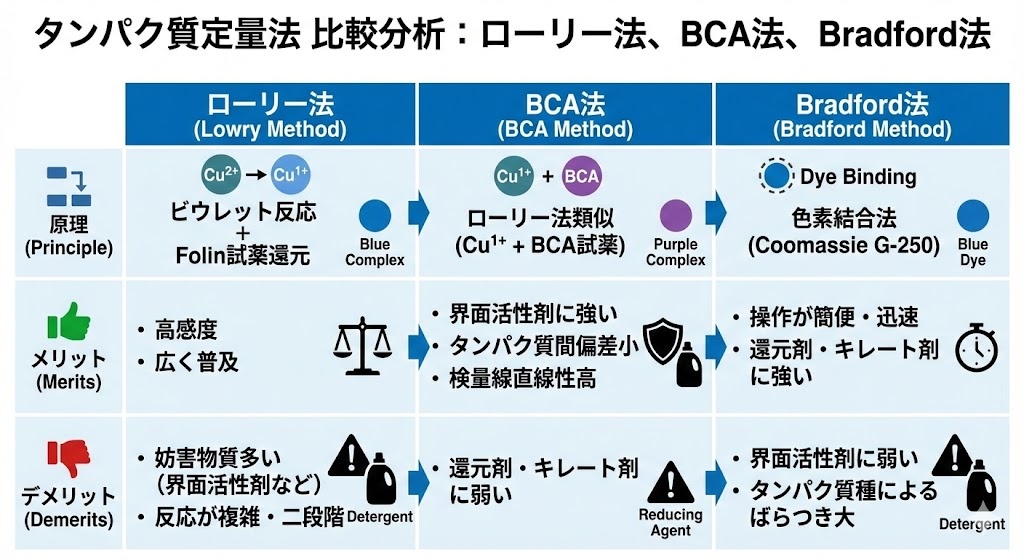
タンパク質定量法には、ローリー法の他にもBCA法やBradford法など様々な手法があります。それぞれに特徴があり、実験の目的や条件に応じて適切な方法を選択することが重要です。
BCA法はローリー法を改良した方法で、界面活性剤との共存性が高いという大きな利点があります。原理的にはローリー法と類似していますが、Folin試薬の代わりにビシンコニン酸(BCA)を使用します。BCA法のメリットとしては、タンパク質間偏差が小さい、検量線の直線性が高い(r²>0.95)、室温保存可能で即時使用できるなどが挙げられます。一方、還元剤や銅イオンのキレート剤により反応が阻害されるという欠点もあります。
Bradford法は、Coomassie Brilliant Blue G-250という色素が酸性条件下でタンパク質の塩基性アミノ酸や芳香族アミノ酸と結合し、吸収極大が465 nmから595 nmへと変化することを利用した方法です。Bradford法の最大の利点は操作が非常に簡便であることと、キレート剤や還元剤の影響をほとんど受けないことです。しかし、界面活性剤の影響を受けやすく、タンパク質の種類による発色のばらつきが大きいという欠点があります。
以下の表は、これら3つの定量法の主な特徴を比較したものです:
| 定量法 | 測定範囲 | 界面活性剤の影響 | 還元剤・キレート剤の影響 | 操作の簡便さ | 反応時間 |
|---|---|---|---|---|---|
| ローリー法 | 1-1,500 µg/mL | 阻害される | 阻害される | 中程度 | 約40分 |
| BCA法 | 20-2,000 µg/mL | 共存可能 | 阻害される | 高い | 約30分 |
| Bradford法 | 10-1,000 µg/mL | 阻害される | ほとんど影響なし | 非常に高い | 約5分 |
ローリー法の歴史的背景と普及の理由
ローリー法が開発された背景には興味深い歴史があります。1920年代初め、北京協和医学院のシェン・ウーは内臓リーシュマニア症研究のため、血清中のタンパク質量を測定する必要がありました。当時利用可能だった屈折率測定法や窒素量測定法を行う設備がなかったため、ウーは既存の設備と器具で実行できる簡便な方法を考案しました。これがホスホ-18-モリブデンタングステン酸とタンパク質中のチロシンを反応させる方法でした。
その後、オリバー・ローリーはこの方法をさらに改良しました。興味深いことに、ローリー自身はこの定量法を論文にすることに消極的だったといわれています。実際、ノーベル賞受賞者のアール・サザーランドがローリーの方法を多くの論文で使用していたものの、公式な発表がなかったため、毎回「Personal communication」や「an unpublished method of Lowry」と記載せざるを得なかったことから、サザーランドの強い要請によってようやく論文化されたという逸話があります。
ローリー法が世界中で広く普及した理由として、ローリー自身は2つの要因を挙げています。1つは方法自体の性質で、当時としては簡便で高感度、結果も安定していたこと。もう1つは、サザーランドに加えてアーサー・コーンバーグというノーベル賞受賞者もこの方法を愛用したため、彼らを通じて普及したのではないかということです。
皮肉なことに、ローリー自身はこの論文を大した業績とは考えておらず、自分の他の研究成果の方が評価されることを望んでいたそうです。しかし、このローリー法の論文は「The Most Highly Cited Paper in Publishing History」に選ばれるほどの影響力を持つことになりました。
ローリー法の実践的応用と外壁塗装業界での活用可能性
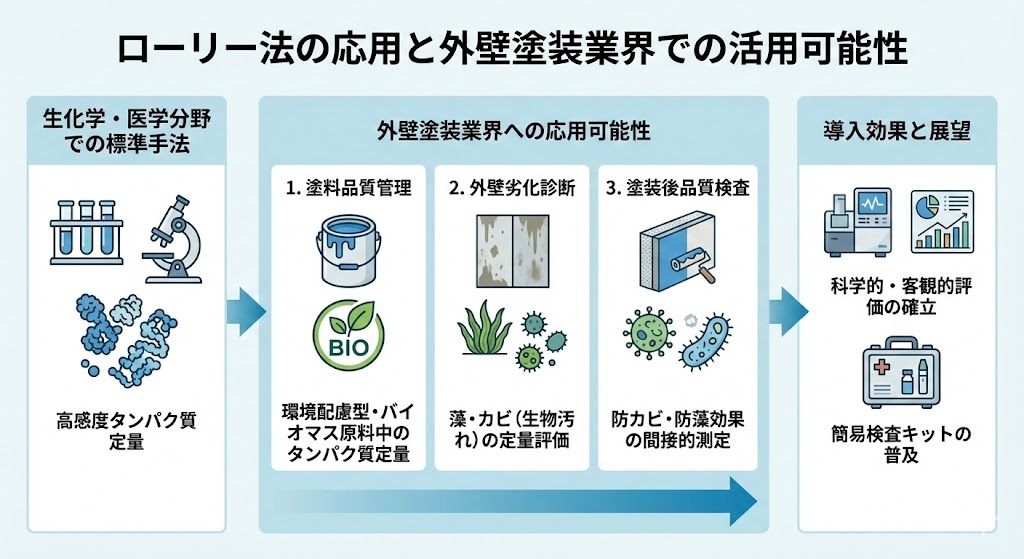
ローリー法は主に生化学研究や医学分野で使用されていますが、その原理や特性は外壁塗装業界においても応用できる可能性があります。特に、塗料の品質管理や成分分析において、タンパク質系添加物の定量に活用できるかもしれません。
例えば、一部の環境配慮型塗料にはカゼインなどのタンパク質が含まれることがあります。これらの成分の正確な定量は、塗料の品質や性能を保証するうえで重要です。また、バイオマス由来の塗料原料が増えつつある現在、原料中のタンパク質含有量を測定する必要性も高まっています。
さらに、外壁の劣化診断においても応用の可能性があります。外壁に付着した藻やカビなどの生物由来の汚れには、タンパク質が含まれています。これらの汚れの程度を定量的に評価するために、ローリー法のような高感度なタンパク質定量法が役立つかもしれません。
また、塗装工事後の品質検査において、塗膜中に含まれる特定の成分を定量することで、施工品質の客観的な評価が可能になるかもしれません。例えば、防カビ・防藻効果を持つ塗料の効果を検証する際に、微生物の増殖度合いをタンパク質量から間接的に測定することが考えられます。
このように、一見関連性が薄いように思える生化学的手法と外壁塗装業界ですが、品質管理や性能評価という観点では共通点があり、ローリー法の原理や特性を応用することで、より科学的で客観的な評価方法を確立できる可能性があります。
塗料メーカーの研究開発部門では、すでにこうした分析手法を取り入れている可能性もあり、今後は施工業者レベルでも簡易的な検査キットなどの形で普及していくかもしれません。
タンパク質定量法の詳細については、以下のリンクも参考になります。
サーモフィッシャーサイエンティフィック - タンパク質定量法の概要と選び方

ローリー ガスマン リースリング ド ロルシュヴィール ヴァンダンジュ タルディヴ キュヴェ イヴ 2010 甘口 白ワイン 750ml フランス アルザス

